von Gaetana Tonti, biowissenschaftliche Forscherin und META-Health Master Practitioner
übersetzt von Kora Klapp
Der Begriff „Metastase“ entstammt dem griechischen META: nach, hinter, und STASIS: Stillstand, Standpunkt, und wird gebraucht, um das Verbreiten von Krebszellen von der primär betroffenen Stelle zu anderen Organen und Körperteilen zu beschreiben. Um dies zu tun, müssen Krebszellen von der ersten Stelle sich zur zweiten Stelle hinbewegen, die sie invadieren. Die Existenz von Krebszellen in peripheren Blutbahnen wurde debattiert, daher möchte ich kurz über die letzten Forschungsergebnisse und Hypothesen berichten, und META-stasen aus einer META-Perspektive diskutieren.
Auch wenn die Entwicklung von disseminierten metastasierenden Krebsprozessen traditionell eher als sequentieller denn als gleichzeitiger Prozess angesehen wird (d. h.die Krankheit tritt zunächst am primären Standort auf, später gefolgt von Verbreitung an entfernten Orten mit lokalem Wachstum (1)), stellen neue Daten diese Theorie in Frage (2, 3), was darauf hindeutet, dass das Vorhandensein von CTCs und DTCs ein sehr frühes, wenn nicht sogar gleichzeitiges Phänomen, schon bei Beginn des Primärtumors ist.
Knochenmark hat sich als ein gemeinsames Zielorgan für metastasierende Zellen erwiesen, unabhängig von der primären Tumorstelle und dem Muster von befundeten Organmetastasen (4). Dies deutet auf einen kausalen Zusammenhang und eine spezifische Bedeutung für das Vorhandensein von DTCs im Knochenmark hin. Tatsächlich wurden DTCs im Knochenmark in allen soliden Tumortypen nachgewiesen, was darauf hindeutet, dass das Knochenmark ein bevorzugtes Reservoir für blutübertragene DTCs sein könnte.
Bisher ist jedoch nicht bekannt, welche Umwelteinflüsse und inneren Faktoren die Rückführung von DTCs aus der Nische des Knochenmarks in andere entfernte Organe fördern können – wie Leber oder Lunge, die häufige Stellen der metastasierenden Ausbreitung sind. Diese vom primären Tumor gelösten Zellen erreichen in der peripheren Blutbahn das Knochenmark, wo sie in einem ruhenden Zustand verbleiben, bis interne und/oder externe Signale sie dazu bringen, sich zu verschiedenen Organen hin zu bewegen und zu Metastasen auszuwachsen (5-7).
Über diese ruhenden Zellen und die für ihre Aktivierung erforderlichen Bedingungen – Umweltfaktoren wiez.B. Immunsystem, Ernährungsumstellungen, Stress, emotionale Traumata, Reparatur von geschädigtem Gewebe in einer Regenerationsphase… – ist noch wenig bekannt. Nach der konventionellen Wissenschaft könnte der ruhende Zustand sowohl durch Veränderungen innerhalb der DTCs (z. B. zusätzliche DNA-Mutationen) als auch durch die umgebende Mikroumgebung (z. B. Abnahme der Immunüberwachung oder erhöhtes angiogenetisches Potenzial (8, 9) gestört werden.
Aber was, wenn es einen sinnvollen biologischen Grund gäbe, um dieses Phänomen zu erklären?
Botschaften aus der Umwelt
Das Verhalten von Krebszellen wird nicht durch eine lineare Reihe von Befehlen reguliert, sondern durch Netzwerke molekularer Wechselwirkungen, die eine Modulation durch Verstärkung oder Hemmung beinhalten. Das Umschalten zwischen verschiedenen zellspezifischen Strategien, die für Krebs entscheidend sind (z.B. Wachstum, Differenzierung, erhöhte Beweglichkeit), kann in normalen und veränderten Zellen ausgelöst werden, und zwar durch Veränderungen der extrazellulären Matrixstruktur (ECM) und zellförmige Verzerrung (10-14), „unspezifische“ chemische Lösungsmittel und elektrische Ionenströme (15-17), die multiple Genaktivitäten beeinflussen, sowie durch unterschiedliche molekulare Faktoren oder spezifische Genmutationen.
Es gibt viele Studien in experimentellen Systemen, die darauf hindeuten, dass Krebs dazu veranlasst werden kann zu ruhen, zu differenzieren, abzusterben oder wieder ganz normale Gewebe zu bilden, wenn sie durch embryonales Gewebe oder andere mikroumweltliche Informationen die richtigen (komplexen) Signale bekommen (18). Dies bedeutet, dass aus irgendeinem Grund die Umgebung des Primärtumors aktiviert werden kann, Signale für Wachstum und Metastasierung freizusetzen.
Dieses Szenario ist ein klares Beispiel für das Erwerben zellbiologisch „hochmaligner“ Merkmale durch einen Anpassungsmechanismus, was stark für Anpassung/Reaktion als Hauptantriebskraft spricht, die der Entwicklung von Neoplasmen (Neubildungen) zugrunde liegt.
Eine neue META-Perspektive von Krebs und META-stasen
Auf dieser Grundlage wurde eine sehr herausfordernde Hypothese vorgeschlagen:
- Krebs ist ein natürlicher Wundheilungsprozess, bei dem das Ergebnis des Krebsmechanismus entweder die Wunde heilt oder das gesamte System erschöpft (Tod).
Wenn im Gewebe Wundsignalmoleküle vorhanden sind, verursachen diese eine Überexpression der bestehenden krebsrelatierten Gene, was zu Veränderungen bestimmter Chromosomen und Krebszellmerkmale führt (19). Daher kann logischerweise über eine Wund-Onkogen-Wundheilung (WOWH) spekuliert werden: Krebsbildung ist ein natürlicher Prozess, den Organismen bei der Wundheilung eingesetzt haben.
Kurz gesagt, wenn definierte Wunden bei Säugetieren auftreten, beginnt der Körper den komplizierten Wundheilungsprozess.
Moleküle wie Wachstumsfaktoren, Zytokine und andere Proteine aus den Zellen im Wundbereich unterbrechen das Gleichgewicht des normalen molekularen Stoffwechsels, was zur Aktivierung entsprechender krebsbedingter Gene führt und in einigen Zellen eine krebsartige Veränderung hervorruft. Die Zellen mit aktivierten Genen können Moleküle absondern, um andere Zellen zu rekrutieren, die Zellproliferation zu stimulieren und die Zelldifferenzierung zu verbessern, um die Wunde zu reparieren. Meist ist die Wunde nach den oben genannten Bemühungen geheilt.
Jedoch wenn die Wundbedingungen noch anhalten, hört dieser WOWH-Mechanismus nicht auf, und mehr Krebszellen teilen sich, um mehr Moleküle für die Wundheilung zu produzieren. Man befundet eine Überaktivierung der krebsbezogenen Gene, die normale Zellen in bösartige Zellen verwandeln (21, 21), und eine klinische Krebsmasse bildet sich. Nachdem die Wunde geheilt ist, initiieren die Moleküle einer geheilten Umgebung die Differenzierung oder den Tod der Krebszellen.
Dieses Modell führt auch zu einem neuen Konzept der Metastasierung
Basierend auf der Idee, dass Krebszellen da sind, um eine Wunde zu reparieren, ist eine META-Erklärung der Metastasierung, dass Krebszellen in der primären Tumorstelle das Vorhandensein von Wunden an entfernten Stellen „spüren“ können, und dass diese Krebszellen durch den Kreislauf wandern können, um die Sekundärwunde zu heilen. An dieser Stelle könnte es interessant sein, den Begriff „Wunde“ zu definieren: Ist es nur eine körperliche Wunde? Aus der META-Perspektive wissen wir, dass körperliche Wunden emotionale/spirituelle Wunden spiegeln.
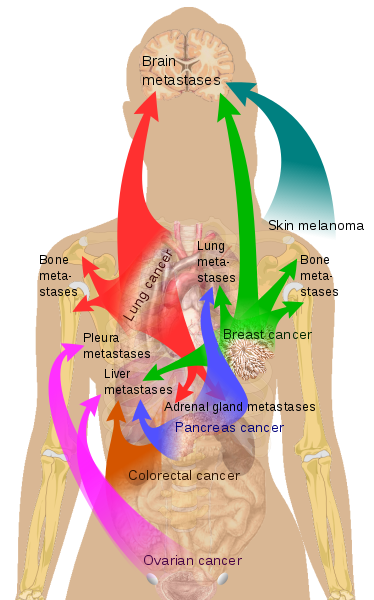
In ähnlicher Weise kann man einen Existenzkonflikt erleiden, wobei man sich Sorgen macht, ob und wie man die Phase überleben können soll, ohne zu verhungern. In diesem Fall würde die Leber beteiligt sein. Auch hier würde es in der Stressphase eine Zunahme der Zellaktivität/-zahl geben, was schließlich zum Adenom oder Adeno-Karzinom führt.
Durch eine Krebsdiagnose fühlen sich viele Menschen wertlos und unfähig, ihre bisherige Lebensführung aufrecht zu erhalten, und in diesem Fall wird das Knochengewebe reagieren. Wie bereits erwähnt, dringen metastasierende Zellen in das Knochenmark ein und befinden sich in einem ruhenden Zustand. Wenn sie aktiviert werden, verursachen sie Knochentumoren. Schließlich wird es im Rahmen der Lösung der Selbstwertkonfliktes eine Verkalkung der Zellen geben und der Knochen wird stärker als zuvor werden.
 Die letzte Frage könnte nun sein: „Warum wandern die Krebszellen aus dem Primärtumor ins Knochenmark, bleiben dort in einem „schlafenden“ Zustand, und warten darauf, geweckt zu werden um schließlich an sekundäre Standorte zu wandern?“ Nach der WOWH-Theorie könnten diese primären Krebszellen eine tiefe emotionale Wunde spüren, die den Kern dessen trifft, wer wir sind – den Sinn den uns das Leben gibt, oder den wir dem Leben geben… der wesentliche Teil dessen, wer wir sind… das Mark.
Die letzte Frage könnte nun sein: „Warum wandern die Krebszellen aus dem Primärtumor ins Knochenmark, bleiben dort in einem „schlafenden“ Zustand, und warten darauf, geweckt zu werden um schließlich an sekundäre Standorte zu wandern?“ Nach der WOWH-Theorie könnten diese primären Krebszellen eine tiefe emotionale Wunde spüren, die den Kern dessen trifft, wer wir sind – den Sinn den uns das Leben gibt, oder den wir dem Leben geben… der wesentliche Teil dessen, wer wir sind… das Mark.
Ich betrachte dieses Ereignis so: wenn eine Person einen primären Krebs entwickelt, will unsere körperliche Intelligenz uns schützen und schickt diese Wundheilungsinformationen direkt in unseren Kern, unser Mark; diese Zellen bleiben dort, ruhend, bereit, sich bei Bedarf zu anderen Organen zu bewegen. Unser Körper ist ein hochintelligenter Organismus, in dem jedes Ereignis und jedes Symptom einen sinnvollen Grund hat zu existieren.
Referenzen:
- Guislaine Barri`ere, Michel Tartary, and Michel Rigaud . Epithelial Mesenchymal Transition: A New Insight into the Detection of Circulating Tumor Cells. Int Schol Res Net ISRN Oncol 2012, doi:10.5402/2012/382010
- Mego M, Mani SA, Cristofanilli M: Molecular mechanisms of metastasis -clinical applications. 2010, 7(12):693-701.
- Kim MY, Oskarsson T, Acharyya S, Nguyen DX, Zhang XH-F, Norton L, Massague J: Tumor self-seeding by circulating cancer cells. Cell 2009, 139:1315-1326.
- Pantel K, Cote RJ, Fodstad O: Detection and clinical importance of micrometastatic disease. J Natl Cancer Inst 1999, 91: 1113–1124.
- Allan AL, Vantyghem SA, Tuck AB, Chambers AF: Tumor dormancy and cancer stem cells: implications for the biology and treatment of breast cancer metastasis. Breast Dis 2006, 26: 87–98.
- Alix-Panabieres C, Muller V, Pantel K: Current status in human breast cancer micrometastasis.Curr Opin Oncol 2007, 19: 558–563.
- Pantel K, Schlimok G, Kutter D, Schaller G, Genz T, Wiebecke B, Backmann R, Funke I, Riethmuller G: Frequent down-regulation of major histocompatibility class I antigen expression on individual micrometastatic carcinoma cells. Cancer Res 1991, 51: 4712–4715.
- Naumov GN, Bender E, Zurakowski D, et al. A model of human tumor dormancy: an angiogenic switch from the non angiogenic phenotype. J Natl Cancer Inst 2006, 98:316.
- Marches R, Scheuermann R, Uhr J. Cancer dormancy: from mice to man. Cell Cycle 2006, 5: 1772
- Kalluri R, Weinberg RA, “The basics of epithelial-mesenchymal transition,” Journal of Clinical Investigation, 2009, 119,6: 1420–1428,
- Klymkowsky MW, Savagner P. Epithelial-mesenchymal transition: a cancer researcher’s conceptual friend and foe. American Journal of Pathology, 2009, 174, no. 5: 1588–1593.
- Hanahan D, Weinberg RA. The hallmarks of cancer. Cell, 2000, 100:57–70.
- Chambers AF, Groom AC, MacDonald IC. Dissemination and growth of cancer cells in metastatic sites. Nature Reviews Cancer, 2002, 2: 563–572.
- Christina Scheel, Tamer Onder, Antoine Karnoub, et al. ADAPTATION VERSUS SEPECTION: THE ORIGINS OF METASTATIC BEHAVIOUR; CANCER RES, 2007, 67:11476-11480.
- Engler AJ, Sen S, Sweeney HL, Discher DE. Matrix elasticity directs stem cell lineage specification. Cell 2006, 126:677–689.
- Huang S, Eichler G, Bar-Yam Y, Ingber DE. Cell fates as high-dimensional attractor states of a complex gene regulatory network. Phys Rev Lett 2005, 94:128701.
- Hellmann P, Grummer R, Schirrmacher K, Rook M, Traub O, Winterhager E. Transfection with different connexin genes alters growth and differentiation of human choriocarcinoma cells. Exp CellRes 1999, 246:480–490.
- Maffini MV, Soto AM, Calabro JM, Ucci AA, Sonnenschein C. The stroma as a crucial target in rat mammary gland carcinogenesis. J Cell Sci 2004, 117:1495–1502.
- Zhou, Y., Ma, B. G., & Zhang, H. Y. Human oncogene tissue-specific expression level significantly correlates with sequence compositional features. FEBS Letters, 2007, 581: 4361–4365.
- Haber, M., & Stewart, B. W. Oncogenes. A possible role for cancer genes in human malignant disease. The Medical Journal of Australia, 1985, 142: 402–406.
- Mitsushita, J., David Lambeth, J., & Kamata, T. The superoxide-generating oxidase Nox1 Is functionally required for Ras oncogene transformation. Cancer Research, 2004, 64:3580–3585
Zum Originalartikel in englischer Sprache
Die vollständige Arbeit kannst Du hier lesen.
pictures:
wikipedia, user Mikael Häggström
wikipedia, userJames Heilmann, MD
Pixabay, user Pexels

 Die Artikel auf META-gesund! werden von Mitgliedern der META-Health International CIC und Gastautoren verfasst. Sie sollen die Gesundheit von Mensch und Welt dadurch fördern, dass sie unser Verständnis vertiefen, wie Resilienz und Wohlergehen erreichbar sind.
Die Artikel auf META-gesund! werden von Mitgliedern der META-Health International CIC und Gastautoren verfasst. Sie sollen die Gesundheit von Mensch und Welt dadurch fördern, dass sie unser Verständnis vertiefen, wie Resilienz und Wohlergehen erreichbar sind.